Sorry we have no English pages

岡山大学・資源生物科学研究所 且原真木(かつはらまき)
このページは、著者の最近の仕事を中心として、「根の研究」誌(根研究会)に書かせていただいミニレビューを、根研究会の許可をいただいて、若干の手直しの上、WEBで公開するものです。出典は
「水の吸収と輸送の分子機構:水チャネル研究の新展開」
根の研究13巻1号(2004年)15−20ページ
です。植物の根に関する研究をしている、あるいは関心がある方は、根研究会のホームページをご覧ください。入会希望については、事務局宛にメールにてご連絡ください。
ここで紹介するミニレビューの著作権は、根研究会に帰属します。許可無く、図表・本文の全体あるいは一部をコピー、あるいは転記して使用することを禁じます。このページにリンクを張ることは自由です
キーワード:アクアポリン,塩ストレス,オオムギ,水チャネル,水輸送
水チャネル・アクアポリンの遺伝子が発見され,細胞の水透過性と水輸送について,その分子機構を研究できるようになった.私たちはオオムギ幼植物の根で発現している水チャネル遺伝子を同定し,その水輸送活性,発現の組織的局在性,発現量とその日周変化等を明らかにした.また水チャネルの発現が植物体の地上部/根の量比に影響することと,耐塩性機構に関係していることを,形質転換植物を使って示した.さらにこの形質転換体で,二酸化炭素の葉内透過性が上昇していたことから,アクアポリンは水だけでなく,二酸化炭素の膜透過を担っている可能性も示唆された.
Discovery of aquaporin (water channel) genes have facilitated investigations into the
molecular mechanisms of cellular water permeability and transport. We isolated
genes of plasma-membrane type aquaporins in barley roots and demonstrated the
water transport activity, tissue localization, and diurnal change in expression
of a particular aquaporin, HvPIP2;1, in barley. Over-expression of HvPIP2;1 increased the shoot/root ratio and raised salt sensitivity
in transgenic rice plants. Furthermore, we noticed the increase in internal CO2
conductance of transgenic plants. This finding indicated that HvPIP2;1
can facilitate permeation of a CO2 as well as water molecule.
水の吸収は高等植物の根の主要な機能の一つとしてよく知られている.空気中の水分によって生育するエアープラントや,周囲から直接葉茎が水を吸収できる海草(アマモなど)や水生植物といった例外を除けば,根によって水が吸収できるかどうかは,陸上植物の生存に直結している.実際,乾燥や高塩濃度によって水吸収がおこなえなくなって植物の成長がとまる,あるいは枯死にいたる,といった事態は珍しいことではない.根がいかに水を吸収して,地上部に水をどのくらい供給できるか,ということは,細胞の伸長成長に直接影響し,最終的には植物の成長量を決定する因子になるので,生理学的にも,農学・作物学的にも古くから興味と関心が注がれてきた.
水の吸収量あるいは移動量(J)は,二つの要素,すなわち駆動力(V)と透過性(G)の積で決まる.すなわち
J = V ´ G (1)
水を動かす力,と言い換えてもよいVの実体は水ポテンシャル差(二つのコンパートメント間,たとえば根内外の水ポテンシャルの差)である.植物は無機イオンの蓄積や適合溶質の合成,あるいは気孔の開閉などを介して水ポテンシャル(浸透ポテンシャルや圧ポテンシャル)を制御する能力を持っている.これについては,生理・生化学的,また近年は分子生物学的に,研究がかなり進んでいる.しかし水の透過性を決めている実体については,長らく不明であった.細胞の水透過性は環境変化に応答するように制御されているのか?制御されているなら,その機構は?このような疑問,特に分子機構についての研究が実際的に始まったのは,1992年に水チャネル遺伝子がヒト赤血球で発見されてからである.翌年には植物でも水チャネル遺伝子が同定されている.タンパクとしてはアクアポリンと呼ばれている水チャネルの遺伝子を最初に発見者したP. Agre博士は,2003年のノーベル化学賞を受賞した.このことは,水チャネル発見の意義がいかに大きかったかを物語っている(詳しくは,前島 2004参照).
 アクアポリンには多くのアイソフォームがあり,解析が進んでいるアラビドプシスやトウモロコシでは,いずれも30個以上の水チャネル遺伝子が知られている.これらアクアポリンはいくつかのグループに分けられるが,主要なメンバーは原形質膜で機能しているアクアポリン(PIPグループ)と,液胞膜で機能しているもの(TIPグループ)である.タンパク質の構造としては6回の膜貫通領域があり,前半,後半に一回ずつAsn-Pro-Alaのモチーフを持つことが特徴である.ヒトのアクアポリンAQP1についての詳細なX線解析から,2つのモチーフ中のAlaが水分子が通過する孔に面して隣接して位置し,水分子の認識・選択に決定的な役割をしていることがわかっている.アクアポリンのいくつかのアイソフォームにおいては,水以外の低分子化合物,すなわちグリセロール,非解離のホウ酸や有機酸,尿素,過酸化水素,低分子アルコール,浸透圧調節物質なども輸送している可能性が示唆されている(Tyerman
et al. 2002).
アクアポリンには多くのアイソフォームがあり,解析が進んでいるアラビドプシスやトウモロコシでは,いずれも30個以上の水チャネル遺伝子が知られている.これらアクアポリンはいくつかのグループに分けられるが,主要なメンバーは原形質膜で機能しているアクアポリン(PIPグループ)と,液胞膜で機能しているもの(TIPグループ)である.タンパク質の構造としては6回の膜貫通領域があり,前半,後半に一回ずつAsn-Pro-Alaのモチーフを持つことが特徴である.ヒトのアクアポリンAQP1についての詳細なX線解析から,2つのモチーフ中のAlaが水分子が通過する孔に面して隣接して位置し,水分子の認識・選択に決定的な役割をしていることがわかっている.アクアポリンのいくつかのアイソフォームにおいては,水以外の低分子化合物,すなわちグリセロール,非解離のホウ酸や有機酸,尿素,過酸化水素,低分子アルコール,浸透圧調節物質なども輸送している可能性が示唆されている(Tyerman
et al. 2002).
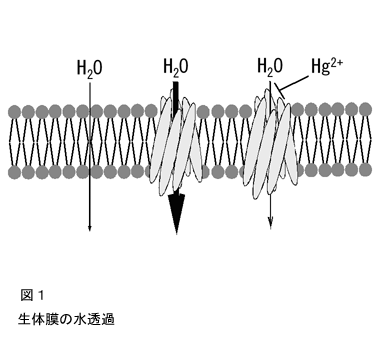
生体膜を構成する脂質二重層を単純拡散する水透過性(Ld)に対して,多くの植物細胞では,その数十倍の水透過性が測定される.これは水チャネルが機能しているためである(図1).水チャネルの阻害剤である水銀イオンで処理したり,水チャネル発現が抑制されたり(Clarkson et al. 2000)すると,細胞の水透過性はLdに近い値まで低下してしまう.液胞膜では一般的に原形質膜よりアクアポリンが多量に発現しており,また水透過性も原形質膜より高い(Tyerman et al. 1999).液胞が水を速やかに吸収することは伸長成長のために望ましい.また理論的に,細胞の浸透圧が変化する場合に細胞質の体積と構造を維持するために,液胞膜は高い水透過性を持つ必要があるとされる.一方で細胞全体を考えた水輸送においては,水透過性が高い液胞膜は制限因子とはならず,細胞の水透過性は原形質膜の性質によって規定されると考えられる.このようなことから,環境変化に応答した細胞の水透過性を制御する分子機構を明らかにすることを目指して,私たちは原形質膜型アクアポリンの研究を行った.なお,水の吸収・輸送とアクアポリンの関係について,より詳しくは別の解説(且原 2003、あるいはこちら)を参照していただきたい.
著者がはじめて水チャネル研究に携わったのは,在外研究でアリゾナ大学に滞在したときである(Yamada et al. 1995).耐塩性植物Mesembryanthemum crystallinum(通称 ice plant)の水チャネル遺伝子が実際に水輸送活性もつことを,アフリカツメガエル卵母細胞の発現系(図2)を使って示した.帰国後,オオムギの水チャネルについて研究を開始した.オオムギは乾燥耐性が強く,水環境への応答はイネとは大きく異なるので,イネと対比させながら研究を進めることで,水チャネルの機能と発現制御の観点から,イネ科植物の水輸送制御の分子機構に迫ることができるだろうと考えた.当時,主要作物では水チャネルの研究はまだほとんど進んでいなかったので,私たちはまずオオムギの水チャネル遺伝子を同定することから研究をスタートさせた.オオムギ幼植物の根において発現している原形質膜型アクアポリンのホモログとして,3つの遺伝子を同定した.これらはシロイヌナズナの遺伝子との相同性から,HvPIP2;1, HvPIP1;3, HvPIP1;5と名付けた(Katsuhara et al. 2002).これら3つの転写産物量を定量すると,HvPIP2;1の転写産物は,根においてHvPIP1;3やHvPIP1;5の転写産物よりも10倍以上多かった.またHvPIP1;3やHvPIP1;5の転写産物量は200 mM NaClによる塩ストレスで影響をほとんど受けず,低いレベルでほぼ一定であったが,HvPIP2;1の転写産物は塩ストレスでほぼ半減した(表1).またウエスタン解析から,塩ストレスによってHvPIP2;1のタンパクも減少することが確認された.このように発現量も多く,環境変化に応答することから,HvPIP2;1に注目して研究を進めた.
表1 オオムギ幼根における3つの原形質型水チャネルのRNA量と200 mM NaCl 24時間処理の塩ストレスによる変化.
(Katsuhara et al 2002 より改変)
1μg total RNA中の各mRNA分子数-単位は106分子
|
|
HvPIP2;1 |
HvPIP1;3 |
HvPIP1;5 |
|
コントロール |
22.0 ± 2.0 |
2.2 ± 0.3 |
1.3 |
|
塩ストレス |
12.5 ± 2.1 |
3.5 ± 1.1 |
0.8 |
まずHvPIP2;1が水輸送活性をもつアクアポリンをコードしていることを確かめた.これには先にも述べたアフリカツメガエル卵母細胞の発現系を使った.ホウレンソウの原形質膜型アクアポリンPM23Aはリン酸化のターゲットとなる配列をC末端付近に持っているが,このターゲット配列と似たアミノ酸配列が,HvPIP2;1の推定アミノ酸配列のC末端付近にも見出された.しかしアフリカツメガエル卵母細胞の発現系では,HvPIP2;1による水輸送活性にリン酸化,脱リン酸化が関与していることを示すデータは得られなかった.水チャネル開閉機構の一つとして,アクアポリンのリン酸化/脱リン酸化が提唱されている(Kjellbom et al. 1999)が,この件に関してはさらに研究を積み重ねる必要がある
根組織内でのHvPIP2;1タンパクの分布をtissue print immunoblotによって調べると,このアクアポリンは根端から5cmのほぼ成熟した部位では,中心柱のまわり,おそらく内皮を含むと思われる部分に多く,次いで表皮を含む皮層外層で多かった(Katsuhara et al. 2003a).道管およびその周辺には見られないことから,HvPIP2;1は,水が道管へ移行する局面ではなく,アポプラストからシンプラストに水が移行するところで機能しているのだろう.なお根端から2mmの未熟な領域では,根組織内でHvPIP2;1はかなり均一に分布していた.
私たちがオオムギHvPIP2;1の研究を進めていたころ,ミヤコグサの根における水透過性とアクアポリンの発現量が相関的な日周変動を示す,という報告が出た(Henzler et al. 1999).私たちもオオムギ幼根の水透過性やHvPIP2;1の転写産物とタンパクを定量してみると,やはり日周変化が見られた(Katsuhara et al. 2003a).以前からいくつかの植物種で根圧や根の水透過性における日周変動は知られており,また組織あるいは細胞の水透過性とアクアポリンの発現量との相関的な日周変化についても,私たちの研究を含めて現在まで数例が報告されている.根の水透過性は昼間に高い例が多いが,発現量変化のパターンは組織,生育ステージ,生育環境によって変わるようだ.朝に透過性とアクアポリン発現が高い例や,明け方に低くなる例もあり,オオムギ幼植物では夜中に根の水透過性とHvPIP2;1の発現が高かった.今回実験に用いたオオムギ幼植物は夜間も盛んな成長を示すので,この成長を実現するためには夜間も地上部に水を供給しなければならない.夜間は蒸散が止まり水を地上部に運ぶ駆動力は大きく減少するので,前述の式(1)からJも大きく減少すると考えられるが,この時にGが大きくなれば,地上部への水の供給量の減少を(ある程度)補償できるのだろう(Katsuhara et al. 2003a).
 形質転換は遺伝子の機能を組織,個体レベルで調べるためにたいへん有力な方法である.オオムギの形質転換については,オーストラリアのグループとの共同研究で挑戦中であるが,まだ成果が報告できる段階にいたっていない.一方これまでに技術が確立されているイネにおいてHvPIP2;1を導入して,その過剰発現イネを得ることができたので,その解析を行った(Katsuhara
et al. 2003b).形質転換T2世代の6322系統では,非形質転換体(以下WT)に比べて根においてHvPIP2;1タンパクの過剰発現と水透過性の上昇が認められた.また地上部/根の重量比をみると,6322系統ではWTに比べてこの値が有為に増加していた.6322系統では根の水透過性が高くなったため,小さな根系でも地上部を維持するのに必要な水を供給できるようになったことを意味するものと考えている.地上部に対して相対的に根が小さくなるという形質は,シロイヌナズの水チャネルを過剰発現させたタバコにおいても同様に見出されている(Aharon
et al. 2003).
形質転換は遺伝子の機能を組織,個体レベルで調べるためにたいへん有力な方法である.オオムギの形質転換については,オーストラリアのグループとの共同研究で挑戦中であるが,まだ成果が報告できる段階にいたっていない.一方これまでに技術が確立されているイネにおいてHvPIP2;1を導入して,その過剰発現イネを得ることができたので,その解析を行った(Katsuhara
et al. 2003b).形質転換T2世代の6322系統では,非形質転換体(以下WT)に比べて根においてHvPIP2;1タンパクの過剰発現と水透過性の上昇が認められた.また地上部/根の重量比をみると,6322系統ではWTに比べてこの値が有為に増加していた.6322系統では根の水透過性が高くなったため,小さな根系でも地上部を維持するのに必要な水を供給できるようになったことを意味するものと考えている.地上部に対して相対的に根が小さくなるという形質は,シロイヌナズの水チャネルを過剰発現させたタバコにおいても同様に見出されている(Aharon
et al. 2003).
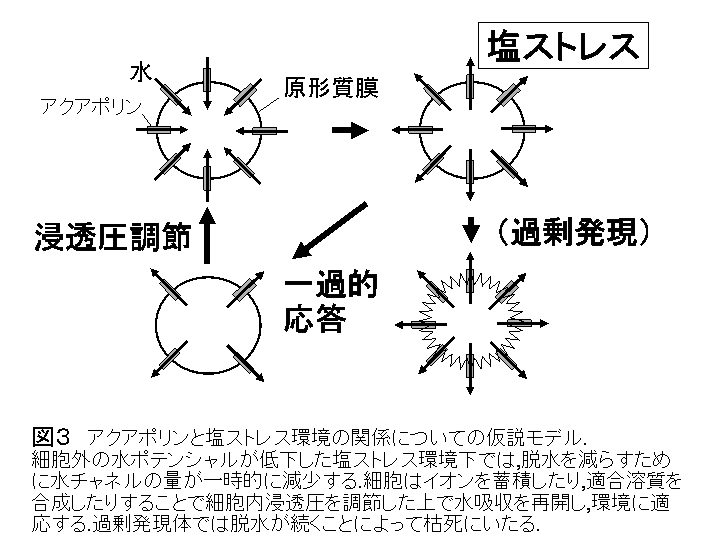
次に水耕培養で100 mM NaClの塩ストレスを与えたところ,WTではストレスを受けて生育は遅くなるが,生育を続けた.形質転換T2のうちで導入遺伝子が発現しなくなった6360系統については,塩ストレスに対する反応はWTと同様であった.一方過剰発現体6322系統では塩ストレスで生育が止まり,枯死した.塩ストレス条件下で水チャネルを介しておこる脱水を,過剰発現体は抑制できなかったためであろうと考えている(図3).
現在,アクアポリンが水以外に二酸化炭素分子も透過させる可能性について共同研究を行っている.今のところ,根での測定ではなく,葉での実験であるが,過剰発現体イネ6322系の緑葉における二酸化炭素透過性(拡散コンダクタンス;gi,測定方法についてはHanba
et al. 2001参照)は非形質転換体コントロールより20%ほど上昇しており,導入タンパクの発現が高い個体ほどgiも高い傾向を認めている(Katsuhara
et al. 2003c).そのような個体では同時に蒸散量や光合成速度も上昇していた.この発見は,光合成速度を決める因子の一つである二酸化炭素の原形質膜透過について,これまで不明であった分子機構にアクアポリンが関係している可能性が高いことを示唆している.光合成器官ではない根においては,呼吸で生じた二酸化炭素をすみやかに細胞外へ排出するために機能しているのかもしれない.最近Nature誌に出された論文(Uehlein
et al. 2003)でも同じような結論,すなわちアクアポリンが二酸化炭素の膜透過を担っている,という報告がされている.
水チャネル遺伝子発見から12年が経ち,アクアポリンが重要な生理現象と結びついているとする研究がいくつも報告されるようになってきた.これまで述べてきたこと以外にも,アクアポリンと冷温障害との関係(Li
et al. 2000),アシドーシスとの関係(Tournaire-Roux et al. 2003)などの報告がある.根の水吸収という古くからの問題が,分子機構という観点から,まさに今,新展開を見せているが,アクアポリンを巡っては解明すべき課題もまだ多く残されている.今後も根と水の関係についてさらに深い理解をもたらしてくれる新知見が,この研究分野から見出されるだろう.
水チャネル研究をスタートさせるきっかけを提供していただいたアリゾナ大学(現イリノイ大学)のBohnert博士,アフリカツメガエル卵母細胞の実験系を教えていただいたカリフォルニア大学サンディエゴ校のSchroeder博士,オオムギの水輸送と水チャネル研究の方向を与えていただいた田澤仁名誉教授,河崎利夫名誉教授,故笠毛邦弘教授に感謝する.また研究室の柴坂博士,秋山技官,西村技官,大学院生諸君の協力で,これまでの水チャネル研究が実施できたことに感謝する.イネ形質転換は(株)植物工学研究所,特に林博士と早川博士の多大のご協力による共同研究である.また二酸化炭素透過性は岡山大学資源生物科学研究所の半場博士との共同研究である.今回紹介させていただいた成果の一部は,農水省大型別枠プロジェクト「バイオデザイン計画」,あるいは科学技術振興機構の戦略的創造研究「植物の機能と制御」の援助によって実施されたものである.
製作者: 且原真木 (kmaki@rib.okayama-u.ac.jp)
著作: 根研究会(http://wwwsoc.nii.ac.jp/jsrr/)