植物の環境ストレス応答機構の理解
植物が環境の変化を認知しそれに応答していることはよく知られていますが、植物のどのような遺伝子またはタンパク質が外環境や内環境の物理的または化学的変化を認識し、さらにそのシグナル情報を細胞内または個体内でどのように情報処理し最適な応答を起動しているかは、ほとんどわかっていません。当研究室ではこの重要かつ遠大な問題に答える為に、植物ホルモンのひとつであるアブシジン酸に注目して研究を進めています。アブシジン酸(ABA)は、種子の成熟など植物の発生、成長制御において重要な役割を演じていますが、乾燥、塩ストレス応答においても気孔の開閉の制御など中心的な役割を担っています。
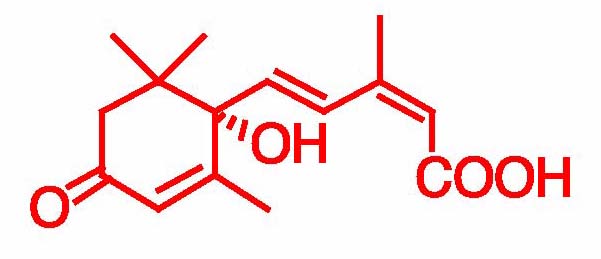
ABAの構造
ABA応答機構
トウモロコシやシロイヌナズナを使った遺伝学的研究や分子生物学的研究などから、ABAの作用に関わる多くのの機能分子が同定されています。また、逆遺伝学的解析により更に多くの関連因子が報告されています(Hirayama & Shinozaki, Trends Plant Sci., 12, 343-, 2007, Plant J., 61, 1041-, 2010)。最近細胞内で働くABA受容体が報告されました(以下参照)。これにより、ABA応答機構の理解も加速されました。しかし、細胞レベル、組織レベルでの応答機構の理解は、まだまだ多くの未解明な点が残されています。特に今後は、ABA応答機構と他の環境刺激応答とのクロストークの詳細な解析が必要です。私たちは、シロイヌナズナを対象にして、主に遺伝学的手法を用いて既存の因子の詳細な機能解析や、他の情報とのクロストークにおける役割の理解を進めています。
新たなABA関連変異株の探索と解析
私たちは、いくつかのABA高感受性変異 (ABA hypersensitive germination) ahg1, 2, 3, 11, 12を分離し解析を行ってきました。これまでにすべての原因遺伝子を同定することに成功し、報告しています(Nishimura et al., Plant J., 44, 972-, 2005, Yoshida et al., Plant Physiol., 140, 2006, 115-, Nishimura et al., Plant J., 50, 935-, 2007, Murayama et al., J. Exp. Bot., 63, 5301-, 2012, Hayashi & Hirayama, Scientific Reports, 6, 2531, 2016)。
ABA高感受性変異株の発芽試験
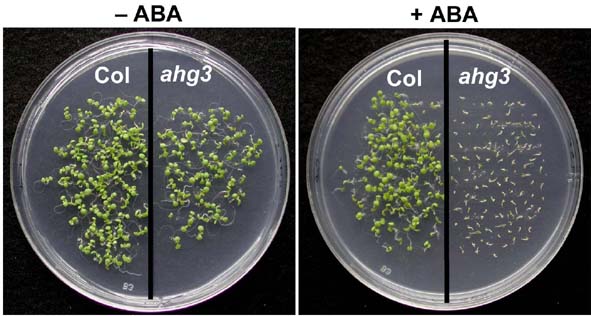
ABA高感受性変異株 (例;ahg3 )は、ABA存在下で発芽及び生育が阻害される。
* AHG1, AHG3の解析
ahg1-1, ahg3-1変異は、発芽時にABA高感受性を示します。これらの原因遺伝子はそれぞれ異なる2C型脱リン酸化酵素(PP2C)の遺伝子をコードしている事がわかりました。私たちが分離した変異は、すべてPP2Cの活性を消失させるものでしたので、これらのPP2CはABA応答を抑制する因子と考えられます。植物は多くのPP2Cを持つことが知られていますが(シロイヌナズナは76個)、このうちAHG1, AHG3も含まれるcladeAと呼ばれるグループのPP2CがABA応答に関わっている事が今回の研究からも明らかとなりました。これらのPP2Cは共に種子で強く発現しておりますが、それぞれ共通する機能と別の機能があると示唆される結果が得られています。
AHG1, AHG3遺伝子の種子での発現の様子 ahg1-1ahg3-1二重変異株
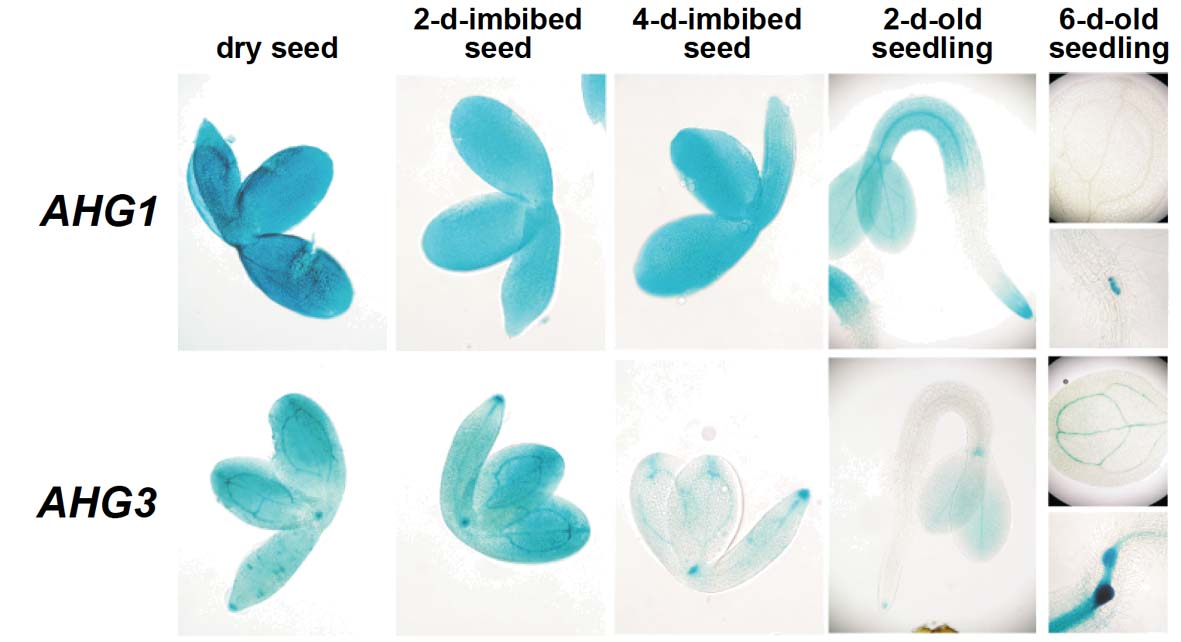

左図: それぞれの遺伝子の遺伝子発現制御領域にGUS遺伝子(産物はある化学物質に働き青色にする)を連結し、植物体に導入。青く見えるところで遺伝子が発現すると考えられる。AHG1, AHG3双方とも種子で強く発現するが、発現する場所の傾向は異なる。右図: ahg1-1ahg3-1の二重変異株のABA感受性。二重変異株ではそれぞれのABA高感受性が加算されているように見える。このことから、AHG1, AHG3の機能は大部分は重複している可能性があるが、それぞれ個別の機能も持つことがわかる (Nishimura et al., Plant J., 50, 935-, 2007)。
ABA受容体
ある刺激の情報伝達経路を理解する為には、その刺激の受容体を同定することが不可欠です。ABA応答については、これまで幾つかの受容体候補が報告されてきましたが、どれも本物でないことがその後示されました。しかし、最近複数のグループから細胞質で働くABA受容体が報告されました(Park et al., Science, 324, 1068- 2009, Ma et al., Science, 324, 1064-, 2009)。これにより、ABA応答経路の解明が一気に進みました。
*ABA情報伝達経路の解析
これまでの我々の研究からPP2CがABA情報伝達において、抑制的に働く重要な因子であることが示されました。一方、SnRK2と呼ばれる一連のリン酸化酵素がABAにより活性化され、またABA応答で重要な役割を担っていることも他の研究グループの解析わかってきました。そこで、SnRK2の研究を進めてきた梅澤博士(農工大)らと共同で、PP2CとSnRK2の関係を明らかにする研究に取り組みました。その結果、PP2CとSnRK2は複合体を形成し、特異的な部位の脱リン酸化PP2CがSnRK2の活性化を抑制していることが示されました。さらに最近報告された細胞質に存在するABA受容体との関連も明らかにしました(Umezawa et al., PNAS, 106, 17588-, 2009)。これによりABAの主要な情報伝達経路を、その刺激の受容から遺伝子発現まで一本の線でつなげることができました。これまで、複雑でなかなか理解できそうにないと思われていたABA情報伝達経路の主要経路は、受容体ーPP2CーSnRK2ー転写因子などのターゲット、で構成されるシンプルな構成であることがわかりました。
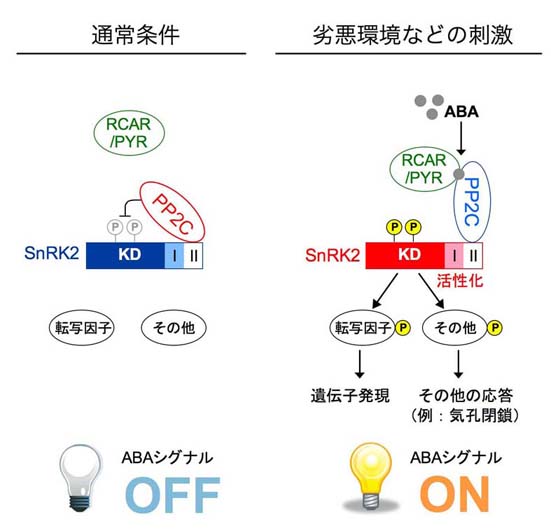
PP2CはSnRK2と複合体を形成、SnRK2の活性化を脱リン酸化により抑制する。ABA受容体(PYR/RCAR)はABA存在下でPP2Cと結合し阻害する。これによりSnRK2が活性化、標的タンパク質がリン酸化されその機能が調節されることでABA応答が引き起こされる。シロイヌナズナにはABA受容体が14、ABA応答に関わるPP2CとSnRK2がそれぞれ9と3つある。情報伝達経路のステップ数は少なく単純に見えるが、全体の構成はやはり複雑と思われる(Hirayama & Umezawa, Plant Signaling & Behave., 5, 160-, 2010)。
* AHG2の解析
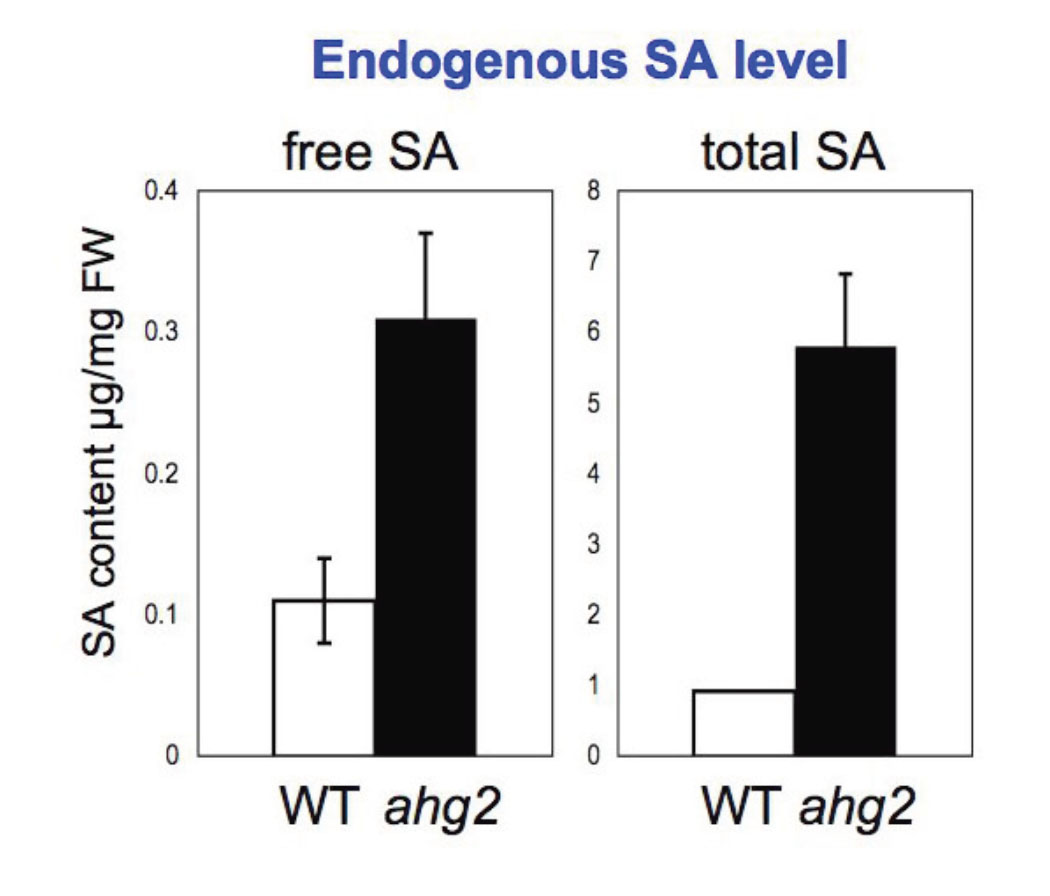
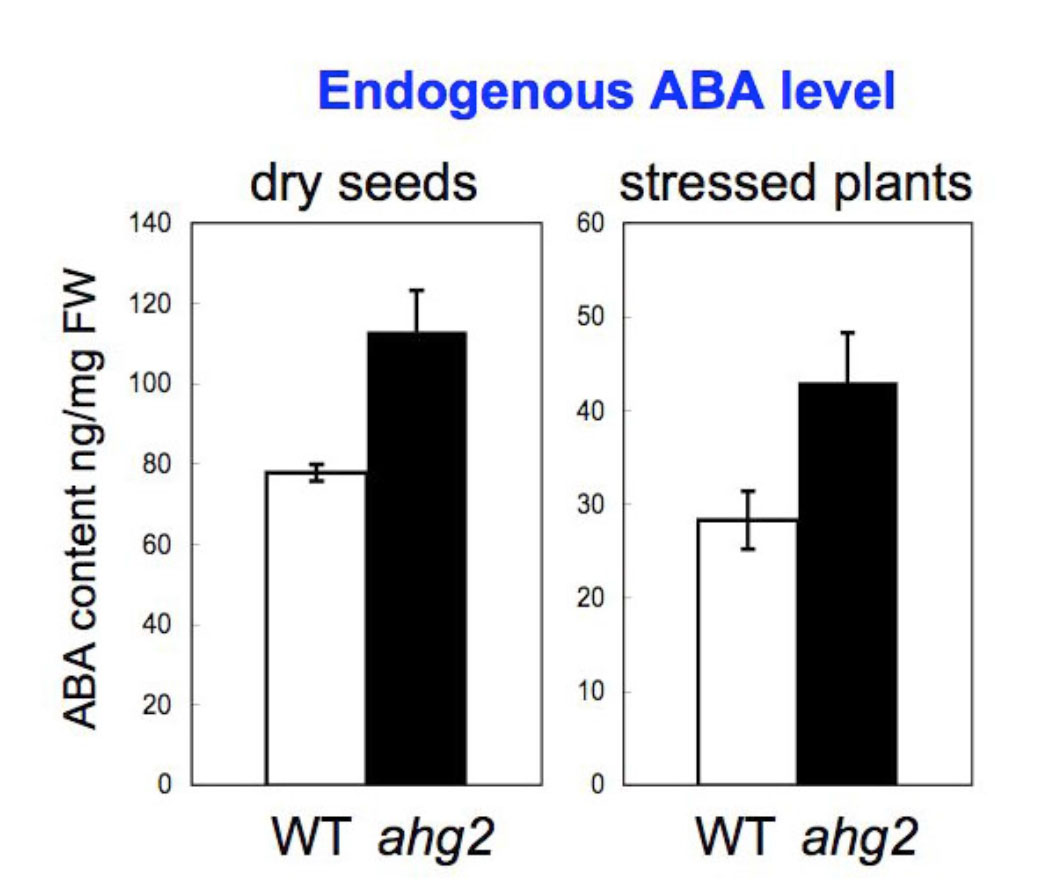
ahg2-1変異株は、発芽時および成長した個体でABA高感受性を示します。この変異の原因遺伝子は、poly(A)特異的RNA分解酵素(PARN)をコードしていることを突き止めました。PARNなどのpoly(A)特異的RNA分解酵素は、mRNAの分解の初発段階を担う因子です。このことから、mRNAの分解制御がABA応答に密接に関与していると考えられます。ahg2-1変異株はABA高感受性以外にもABAと拮抗的に働くと言われているサリチル酸の高感受性、さらにわい性を示すなど、多様な表現型が見られます。
AHG2/PARNの機能についてのモデル
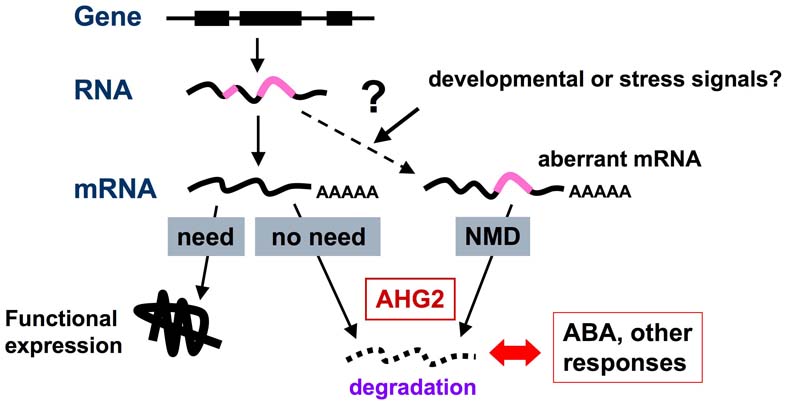
異常なmRNAや不必要になったmRNAは速やかに分解される。この過程でAHG2/PARNが機能していると推察される。この機能が低下すると、分解されるべきmRNAが蓄積して様々な障害が発生し、結果的にABA高感受性が引きこされると考えられる。
* AHG2は植物特有の機能を持つ
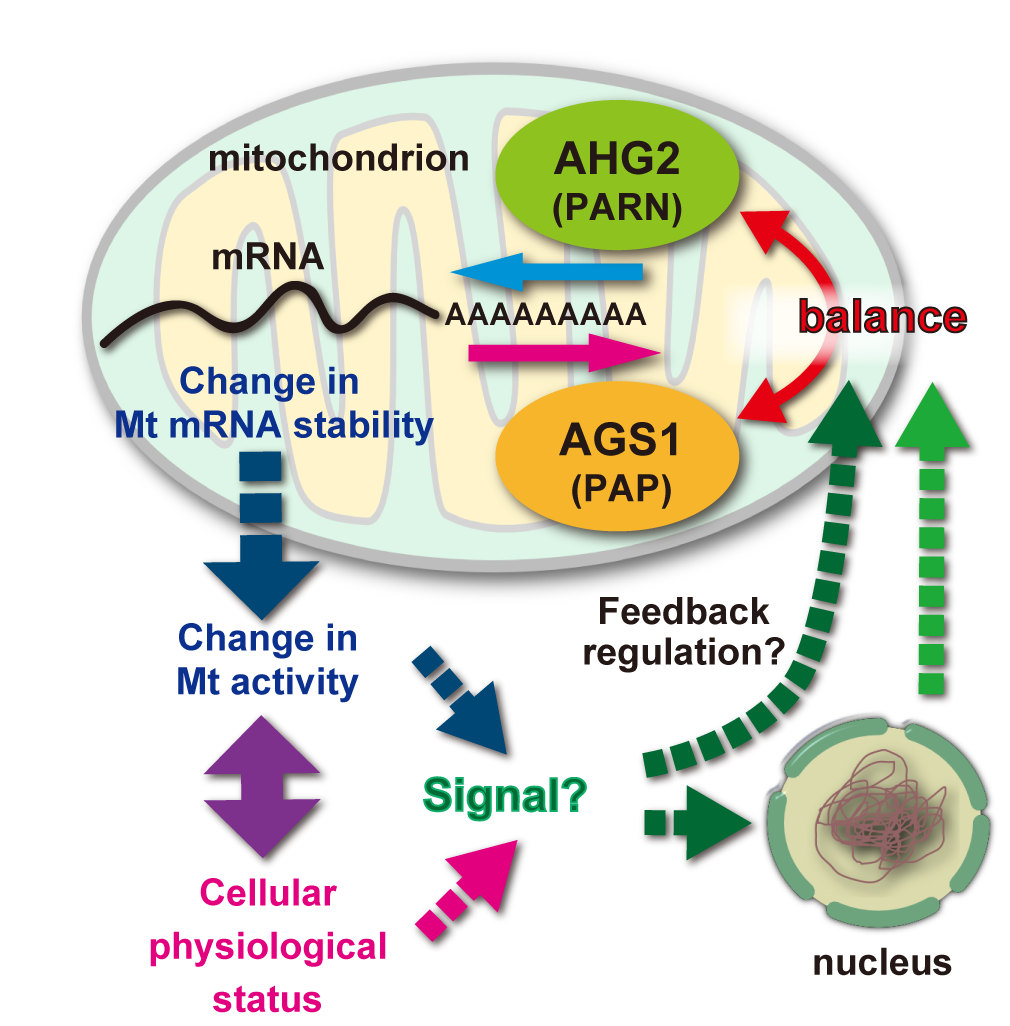
ahg2-1を用いた遺伝学的解析及びマイクロアレーを用いた詳細な解析から、AHG2/PARNはpoly(A)付加酵素であるAGS1と協調して、ミトコンドリアのmRNAのpoly(A)鎖を直接調節していることが明らかとなりました(Hirayama et al., Nat. Commun., 4, #2247, 2013)。他の真核生物ではPARNは細胞質のmRNAのpoly(A)除去に関与していることが報告されており、オルガネラで働くというのはこの報告が初めてで、植物の特異性がまたひとつ見出されました。植物にはゲノムを保有するオルガネラがミトコンドリアと色素体と複数あることから、オルガネラ遺伝子の発現制御機構が特殊化した可能性があります。今後はAHG2, AGS1の調節機構やストレス応答下でミトコンドリア機能と細胞機能の関係についての解析が必要です。
*AHG1, AHG3は種子休眠・発芽の制御でハブ的役割を担う
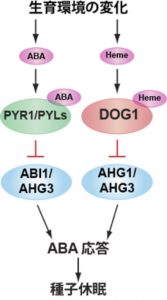
これまでの解析からAHG1やAHG3は他のアブシシン酸応答PP2Cとは異なる機能を持っていることが伺えました。そこで、AHG1と相互作用する因子をpull-down法により探索しました。相互作用因子の候補にはDOG1が見出されました。DOG1は、種子の休眠制御に関わる因子として同定された因子ですが、その生化学的機能は未解明でした。詳細な研究からAHG1やAHG3は、アブシシン酸の情報とDOG1からの休眠の情報、両方を受け取り、下流の因子の制御を行うハブ的役割を担っていることを明らかにしました(Nishimura et al., Nature Communications, 9, 2132, 2018) (下図)。
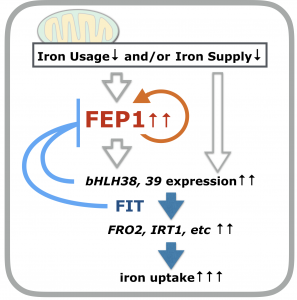
* 新規鉄応答制御因子FEP1の同定とアブシシン酸応答との関係
ahg2-1変異の解析から、この変異株は鉄が十分に供給されているにもかかわらず恒常的に鉄欠乏応答をしていることがわかりました。網羅的転写物解析から、新規の短鎖ペプチド(47aa)をコードする遺伝子FEP1が、この変異株で高発現されていることを見出しました。様々な解析から、FEP1遺伝子は鉄応答欠乏状況下で発現が誘導され、FEP1の人為的誘導発現のみで、植物細胞または組織内で鉄の取り込みに関わる遺伝子の発現が誘導され、また鉄が蓄積されることがわかりました。この鉄応答遺伝子発現誘導は、これまでに知られていない機構によることもわかりました。CRISPR/Cas9によるfep1欠損変異の作成とその解析から、FEP1は個体全体の鉄欠乏応答統御に関わることが示唆されました(Hirayama et al., Plant Cell Physiol., 2018) (下図)。現在、アブシシン酸応答、ミトコンドリア機能との関連を視野に入れながら、FEP1が関わる制御機構の分子レベルでの解明を進めています。
>>> その他の変異株
>>> データ駆動型作物デザイン技術の開発