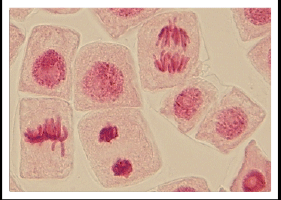
オルセイン染色〜高校授業級〜
試薬
・酢酸オルセイン液(または酢酸カーミン液)
・45%酢酸
器具
・管瓶(直径 2 cm、高さ 5 cm程度のガラスビン)
・ピンセット
・濾紙
・60℃のお湯
・スライドガラス
・安全カミソリ
・柄付き針
・18 x 18 mmカバーガラス
・つつき棒(割り箸等を鉛筆削りで削って作製する。または、消しゴム付き鉛筆の消しゴム部分を使う)
染色体標本の作製
染色体標本の作製法は植物種によって適した前処理法、固定法、標本の作製法がある。今回は、「ネギ類を材料に用いた押しつぶし法」の例を述べつつ、他の例については、その度に説明を加える。まずは、「実験操作の概要」を先に説明し、その後「詳細な実験ステップ」について説明する。
前処理(細胞周期の全ての時期を見たいときには不要)
前処理とは標本における中期細胞の割合を増やすために行う操作である。チャプタ1で解説したように、細胞中の染色体DNAは間期核では一部の領域を除いて伸びた状態にある。私たちがイメージする染色体の形をとっているのは中期のみである。そのため、「いわゆる染色体」を観察するためには、この時期の細胞の割合を増やす必要がある。しかし、反対に「細胞周期の各時期を全て見たい場合」には、この処理は不要である。
中期細胞を増やすためには、紡錘糸の形成を阻害し細胞を後期へ移行しないようにするのが一般的である。普通、コルヒチンやキノリンなどの薬剤がこのために使われる。低温に強い植物(ネギ類やムギ類など)では、0℃で紡錘糸の合成が阻害されるので、この現象を利用してムギ類では0℃、20時間の前処理を行う。この低温処理法は、暖かい気候で育つ植物(イネやトウモロコシなど)では低温生育傷害が起きてしまうので適用できない。
固定
生物の実験では、「組織や細胞を生物の中にあるのに近い状態で保存する操作」の事を「固定」という。植物の染色体観察の固定には、通常エタノール:酢酸 = 3 : 1の固定液が使われる。ネギ類やムギ類の場合3日から1週間程度の固定が、標本作りに適している。
解離および染色体の展開
細胞と細胞の間の接着をはずし、バラバラにすることを「解離」という。また、細胞および細胞内の染色体をスライドガラス上に広げる操作を「展開」という。押しつぶし法では、 45%酢酸や薄い塩酸で細胞を解離させた後、サンプルを押しつぶすことにより物理的な力によって細胞壁を破壊し染色体を展開する。酵素解離方では、セルラーゼやペクトリアーゼなどの細胞壁分解酵素によって細胞壁を加水分解して解離させ、解離した細胞を空気乾燥法により展開する。ネギ類およびムギ類では主に押しつぶし法が用いられる。
押しつぶし法の詳細
「前処理」(必要な場合)および「固定」は、「概要」で述べた方法により、あらかじめ済ませておく。
1. 管瓶に45%酢酸を入れ、その中に根を浸ける。
2. 管瓶を60℃のお湯に10分間浸ける。
3. 管瓶に酢酸カーミン液を2-3滴入れ、その中に根を浸け、30分放置する。
4. 根端をスライドガラスの上に載せ安全カミソリ(またはピンセット)で根端を切り取る。

5. ピンセットで挟みつぶし粉々にする。

6. 45%酢酸を1滴たらし18 x 18 mmカバーガラスをかぶせる。
7. カバーガラスの上からつつき棒で軽く数回たたくことにより細胞を拡散させる。

8. 濾紙(2枚)を二つ折りにした間にスライドガラスを置き細胞の載っている部分を親指で押しつぶす(この際にずらしたり、ひねったりしてしまうと細胞が丸まってしまう)。

9. 顕微鏡で観察する。