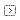![]()
試薬
・微小管固定バッファー(MTSB)
作り方:
1. 1.5 g PIPES, 0.19 g EGTA, 0.13 g MgSO4 7H2Oおよび0.5 g KOHを800 mlの蒸留水に溶かす。
2. KOHを使ってpHを7.0に調整する。
3. 蒸留水により液量を1000 mlに調整する。
・3% (w/v) パラフォルムアルデヒド in MTSB(4℃保存。実験には調整後1週間以内のものを用いる。廃液は、フォルマリン廃液として処理する。)
作り方:
1. 10 mlのMTSBを80℃に温める。
2. 0.3 g パラフォルムアルデヒドを加え、沸騰しないように溶かす(湯煎が望ましい。ドラフト内で行う)。
・10 x PBS緩衝液
作り方:
1. 80 g NaCl, 2 g KCl, 35.8 g Na2HPO4 12H2Oおよび2.4 g KOHを800 mlの蒸留水に溶かす。
2. HClを使ってpHを7.4に調整する。
3. 蒸留水により液量を1000 mlに調整する。
・PBS緩衝液
作り方:
1. 10 x PBS緩衝液を蒸留水で10倍希釈する。
・1% (w/v) cellulase, 0.5% (w/v) pectolyase in PBS buffer(-20℃保存)
作り方:
1. 0.1 g Cellulase Onozuka RS (ヤクルト薬品工業)および50 mg Pectolyase Y-23(盛進製薬)を10 mlのPBS緩衝液に溶かす。
・4 x TNB(-20℃保存)
作り方:
1. 4 ml 1 M Tris-HCl (pH7.5), 0.35 g NaCl, 0.2 g Blocking reagent(Roche)を4 mlの蒸留水に加える。
2. 沸騰しないように温めながら溶かす(湯煎が望ましい)。
3. 蒸留水で10 mlにメスアップする。
・1次抗体反応液(保存不可)
作り方:
1. 4 x TNBを蒸留水で4分の1に希釈し、スライドあたり100 μlのTNB溶液を作る。
2. ウサギ抗AfiCENH3抗体およびマウス抗αチューブリン抗体(SIGMA T6199)を1 μlずつ加える。
・2次抗体反応液(保存不可)
作り方:
1. 4 x TNBを蒸留水で4分の1に希釈し、スライドあたり100 μlのTNB溶液を作る。
2. 抗ウサギAlexa Fluor 555抗体(Invitrogen)と抗マウスAlexa Fluor 488抗体(Invitrogen)を1 μlずつ加える。
・Prolong antifade gold(Invitrogen)
器具
・PLLコートスライドガラス(MASTUNAMI S7441等)
・ピンセット・安全カミソリ
・濾紙・24 x 40 mmカバーガラス
・染色瓶
・25 x 25 mmパラフィルム
・湿箱(プラスチック容器にスノコを入れたもの。写真参照)
実験操作(Nagaki et al. 2004 & 2012に基づく)
1. 2 cm程度に切断した根端を 3% (w/v) パラフォルムアルデヒド in MTSB中、室温で20分間固定する。
2. 溶液を取り除き(フォルマリン廃液として処理すること)、PBS緩衝液で10分間ずつ2回洗浄する。
3. 根端分裂組織を切り出し、1% (w/v) cellulase, 0.5% (w/v) pectinase in PBS buffer中、37℃で1時間処理する。
4. 溶液を取り除き、PBS緩衝液で10分間ずつ2回洗浄する。
5. スライド1枚あたり5 μlのPBS緩衝液を加え、消化された根端分裂組織を緩衝液に懸濁する。
6. PLLコートスライドガラスに5 μlの懸濁液を載せる。
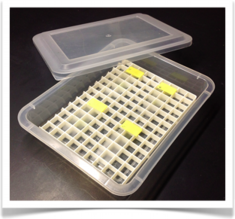
7. 24 x 40 mmカバーガラスを図のように十字状にかぶせ、濾紙に挟み込み押しつぶす。
8. カバーガラスをはぎ取り、スライドを染色瓶中のPBS緩衝液に浸ける。
9. 100 μlの1次抗体反応液をスライド上のサンプルに加え、25 x 25 mmに切断したパラフィルムで被う。
10. スライドを蒸留水を入れた湿箱に入れて、4℃で一晩反応させる。
11. パラフィルムを取り除き、 スライドを染色瓶中でPBS緩衝液により洗浄する(3回)。
12. 100 μlの2次抗体反応液をスライド上のサンプルに加え、25 x 25 mmに切断したパラフィルムで被う。
13. スライドを蒸留水を入れた湿箱に入れて、37℃で1時間反応させる。
14. パラフィルムを取り除き、スライドを0.1 μg/ml DAPI in PBS bufferに10分間浸ける。
15. スライドを染色瓶中でPBS緩衝液により洗浄する。 スライドを染色瓶中で蒸留水により洗浄する(3回)。
16. 37℃でスライドを乾燥させる。
17. 5 μlのProlong antifade gold(Invitrogen)をスライド上のサンプルに載せ、カバーグラスでカバーする。
18. 37℃で30分間インキュベートする。
19. 蛍光顕微鏡もしくは共焦点レーザー顕微鏡で観察する。
 iPad用iBooks版はこちら
iPad用iBooks版はこちら

 オルセイン染色〜高校...
オルセイン染色〜高校...